Les appareils NIRS proposés par Mtraining permettent de monitorer l’oxygénation musculaire ou cérébrale. Cette méthode repose sur deux caractéristiques du tissu humain. La transparence relative des tissus à la lumière dans le proche infra-rouges et les caractéristiques d'absorption de la lumière par certaines molécules en fonction de leur oxygénation.




Pourquoi mesurer l'oxygénation ?
Ces capteurs NIRS permettent de mesurer la quantité d’oxygène disponible en temps réel dans les tissus au niveau du capteur, que ce soit pour évaluer l’efficacité de l’oxygénation pendant un exercice physique, diagnostiquer une anomalie vasculaire, ou étudier le fonctionnement de l’activité cérébrale. Des informations précieuses peuvent alors être obtenues sur la perfusion sanguine et l’activité métabolique.
Pour permettre la contraction d’un muscule, l’oxygène fournit par la respiration peut être utilisé pour produire de l'adénosine triphosphate (ATP), la principale source d'énergie pour les cellules. Cet oxygène est distribué dans les tissus via le sang grâce à l’hémoglobine, protéine des globules rouges qui contient 4 sites de fixation (Fig. 1). Le sang oxygéné arrivant au muscle est riche en Oxyhémoglobine (O2Hb), et le sang appauvri est riche en Désoxyhémoglobine (HHb). En cas d’exercice intense, les muscles peuvent consommer de l'oxygène à un rythme plus élevé que la circulation sanguine ne peut en fournir, produisant de l’acide lactique témoin de la fatigue musculaire. Si la consommation d’oxygène augmente, la concentration en O2Hb diminue contrairement à celle de HHb. La NIRS peut donc être utile pour monitorer l'intensité de l'effort et optimiser la performance.

Fig. 1 : Situation et structure d'une molécule d'hémoglobine, permettant de fixer 4 molécules de dioxygène.
Fonctionnement de la NIRS
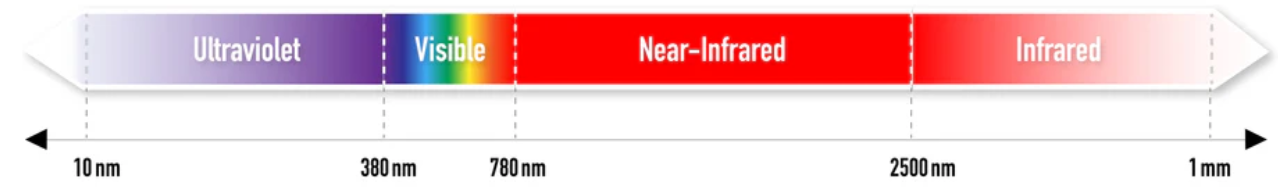
La technologie NIRS repose sur la spectroscopie proche-infrarouge (Near-InfraRed Spectroscopy), soit l’analyse de l’absorption de certaines longueurs d’ondes lumineuses par le tissus analysé. En effet, le corps humain ne laisse pas passer la lumière visible, mais est plutôt transparent aux proches-infrarouges (NIR).

Le dispositif est composé d’une partie émettrice d’infrarouges, et d’une partie réceptrice. Le calcul de la différence d’intensité à l’entrée et à la sortie du tissus permet alors de connaître les variations de concentration d’un chromophore (partie d’une molécule responsable de la couleur, en absorbant une partie de la lumière) par le principe d’absorption de Beer-Lambert.
L’intensité d’un faisceau lumineux s’atténue proportionnellement en fonction de l’épaisseur du milieu traversé et de la concentration. Les molécules traversées absorbent plus ou moins l’énergie des photons en fonction de leurs caractéristiques chimiques, et de la longueur d’onde utilisée. C’est le principe d’absorption.
![]()
OD λ est un facteur sans dimension appelé densité optique du milieu (ou absorbance), I 0 est la lumière incidente, I la lumière transmise, ε λ le coefficient d'extinction du chromophore (en µM -1 .cm -1 ), c la concentration (en µM) du chromophore, L la distance (en cm) entre les points d'entrée et de sortie de la lumière et λ la longueur d'onde utilisée (en nm).
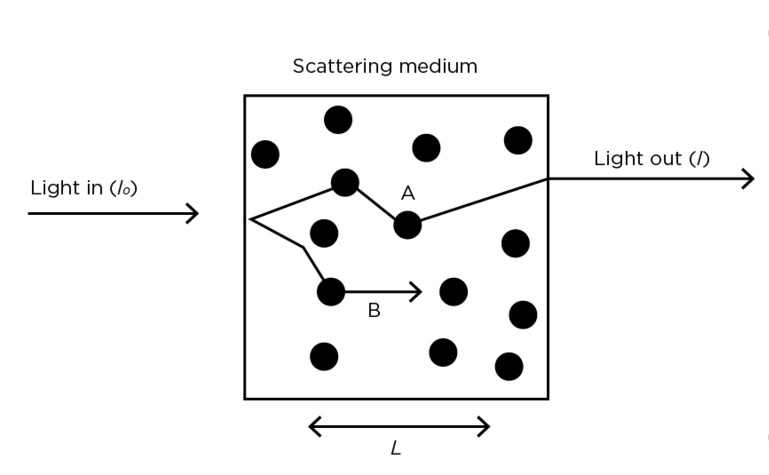
Fig. 2 : Schéma de diffusion des photons pour un milieu diffusant.
La loi de Lambert-Beer est destinée à être utilisée dans un milieu transparent et non diffusant. Lorsqu'elle est appliquée à un milieu diffusant comme le tissu biologique (Fig. 2), un facteur de correction doit être incorporé. Ce facteur, appelé facteur différentiel de chemin optique (DPF – Differential Path length Factor), tient compte de l'augmentation du chemin optique causé par la diffusion dans le tissu. Un terme G inclus également les pertes optiques. La loi de Lambert-Beder modifiée pour un milieu diffusant est donnée par la formule suivante :
![]()
En supposant que les pertes sont constantes lors d’une même mesure, la variation de concentration peut ainsi être calculée à partir des variations de densité optique. Cette équation est valable pour un milieu comportant un seul chromophore. Si plusieurs chromophores sont impliqués, autant de longueurs d'onde doivent être utilisées pour obtenir un système d'équations linéaires.

Les mesures possibles
Si les différences d’absorption entre l’O2Hb et la HHb peuvent être perceptibles à l’œil nu (O2Hb plus rouge que la HHb), et que leur différence d’absorption est maximale pour 660 nm, il faut regarder dans la fenêtre NIR pour que les longueurs d’ondes puissent traverser le tissus humain. Les écarts d’absorption sont maximaux autour de 750 et 850 nm (Fig. 3). L’utilisation de ces deux longueurs d’onde permet ainsi d’étudier les variations de concentration de l’O2Hb et la HHb. La variation de concentration de l’hémoglobine totale (tHb) est calculée comme :
[tHb] = [O2Hb] + [HHb]

Fig. 3 : Différences d'absorption de O2Hb et HHB en fonction de la longueur d'onde.

Fig. 4 : Plusieurs émetteurs (en jaune) espacés de différentes distances.
La saturation en oxygène du tissu (absolue) peut être obtenue à l’aide de la Spectroscopie à Résolution Spatiale (SRS). Cette technique met en jeu différentes distances inter-optodes (Fig. 4) et permet ainsi une meilleure estimation de ε.[C].L grâce à une régression en fonction de la distance. La conception du système SRS améliore la contribution des tissus plus profonds, tout en réduisant la contribution des tissus plus superficiels comme la peau/le tissu adipeux. La saturation du tissus en oxygène est souvent donnée sous la variable de saturation musculaire en O2 (SmO2), ou d’indice de saturation tissulaire (TSI), tous calculés comme :
StO 2 = [O2Hb] / [tHb]
La somme de O2Hb et HHb est une mesure du volume sanguin total (tHb) dans le tissu. Cependant, un deuxième chromophore est impliqué par le transport de l’oxygène la myoglobine (Mb). Ses versions oxygénées et non oxygénées ont des caractéristiques d’absorption dans l’infrarouge trop proches de celles de la Hb. Cela signifie que la NIRS ne peut pas distinguer si la concentration d'oxygène mesurée est transportée par l'hémoglobine ou la myoglobine. Les longueurs d'onde qui permettent de distinguer l'Hb et la Mb ne peuvent pas pénétrer suffisamment dans le tissu humain.
Ainsi, les capteurs NIRS peuvent fournir des valeurs de concentrations relatives d’oxyhémoglobine, de désoxyhémoglobine, et d’hémoglobine totale.
Les différentes technologies
Tout d’abord, la nature de la source lumineuse a une influence. Une diode electro-luminescente (LED) est un semi-conducteur qui émet des photons lorsqu’un courant électrique la traverse. La lumière est alors dite « incohérente » : les ondes ne sont pas synchronisées, et leur fréquence peut quelque-peut varier. La méthode d’amplification de lumière par émission stimulée de rayonnement (LASER) produit une lumière « cohérente » : un faisceau concentré d’une seule longueur d’onde (Fig. 5) rendant les mesures NIRS plus précises .
Le laser, d’une puissance supérieure, permet des mesures plus profondes dans le tissu. Les optodes espacées de 6 cm pénètrent jusqu’à 3 cm (contre 2 cm de profondeur pour les appareils LED). Cependant, les systèmes laser sont volumineux, contiennent davantage d’électronique pour maintenir les laser à température constante, et sont raccordés au sujet par de grandes fibres optiques. Tandis que les systèmes LED sont entièrement portables, plus abordables, et adaptés pour monitorer la majorité des situations.

Fig. 5 : Répartition des spectres d'émission LED et Laser.
La méthode de traitement des intensités est également primordiale, puisque les concentrations calculées découlent de ces mesures. 3 méthodes de spectroscopie sont utilisées :

Si la méthode CW-NIRS a été améliorée à l’aide de la SRS, le DPF est supposé constant et la détermination de la distance parcourue par les photons n’est pas exacte. Les valeurs absolues de [O2Hb] et [HHb] ne peuvent alors pas être directement mesurées.
La TD-NIRS utilise la théorie de la diffusion pour calculer les différents coefficients d'absorption ainsi que le chemin optique moyen parcouru par les photons. Elle permet des mesures absolues des concentrations [O2Hb], [HHb] et [tHb].
La FD-NIRS utilise des grandes fréquences (>100 MHz) et permet également la mesure des concentrations absolues. Cependant, leur mise en œuvre est plus complexe et repose sur l’hypothèse que le tissu est homogène et isotrope (diffusion identique dans toutes les directions de l’espace). Elle est donc peu adaptée pour des mesures in-vivo.
Pour conclure
La technologie NIRS a permis une compréhension plus approfondie des mécanismes musculaires et cérébraux en étudiant leur oxygénation. Les capteurs miniaturisés et non invasifs facilitent un suivi de la consommation et des apports en oxygène au plus proche du lieu de consommation. Cet indicateur hémodynamique est également pertinent lorsqu'il couplé à d'autres mesures comme l'analyse du métabolisme par échanges respiratoires, ou bien l'activité électrique du cerveau par électroencéphalogramme : ce sera l'objet d'un prochain article !
|
Laurent Royer Navigant dans les sciences biomédicales, guidé par la boussole de la curiosité... |
Références bibliographiques :
- Barstow T. J. (2019). Understanding near infrared spectroscopy and its application to skeletal muscle research. Journal of applied physiology, 126(5), 1360–1376. https://doi.org/10.1152/japplphysiol.00166.2018
- Beer, A. (1852). Bestimmung der Absorption des rothen Lichts in farbigen Flüssigkeiten. Annalen der Physik und Chemie, vol. 86, 78-88.
- Fritschi, R., Seiler, J., & Gross, M. (2021). Validity and Effects of Placement of Velocity-Based Training Devices. Sports, 9(9), 123. https://doi.org/10.3390/sports9090123
- Jöbsis F. F. (1977). Noninvasive, infrared monitoring of cerebral and myocardial oxygen sufficiency and circulatory parameters. Science (New York, N.Y.), 198(4323), 1264–1267. https://doi.org/10.1126/science.929199
- Jones, S., Chiesa, S. T., Chaturvedi, N., & Hughes, A. D. (2016). Recent developments in near-infrared spectroscopy (NIRS) for the assessment of local skeletal muscle microvascular function and capacity to utilise oxygen. Artery research, 16, 25–33. https://doi.org/10.1016/j.artres.2016.09.001
- Kocsis, L., Herman, P., & Eke, A. (2006). The modified Beer-Lambert law revisited. Physics in medicine and biology, 51(5), N91–N98. https://doi.org/10.1088/0031-9155/51/5/N02
- Lambert, J. H. (1760). Photometria sive de mensura et gradibus luminis, colorum et umbrae. Sumptibus viduae Eberhardi Klett, typis Christophori Petri Detleffsen.
- Mansouri, C. & Kashou, N. (2012). New Window on Optical Brain Imaging; Medical Development, Simulations and Applications. https://doi.org/10.5772/30609.
- Messere, A., & Roatta, S. (2013). Influence of cutaneous and muscular circulation on spatially resolved versus standard Beer-Lambert near-infrared spectroscopy. Physiological reports, 1(7), e00179. https://doi.org/10.1002/phy2.179
- Prahl, S. (1998). Tabulated Molar Extinction Coefficient for Hemoglobin in Water. Oregon Medical Laser Center: Portland, OR, USA.






















































 Tapis Anti Gravité : quand la réduction de la gravité transforme la rééducation
Tapis Anti Gravité : quand la réduction de la gravité transforme la rééducation
 Différences de raideur au sein du tendon rotulien
Différences de raideur au sein du tendon rotulien
 NIRS et canaux courts : une méthode utile en musculaire et cérébrale
NIRS et canaux courts : une méthode utile en musculaire et cérébrale
 Banc de mesure de force pour les perches. Mais pourquoi?
Banc de mesure de force pour les perches. Mais pourquoi?
 Comment effectuer des prélèvements de lactate sanguin
Comment effectuer des prélèvements de lactate sanguin
 Actualités
Actualités
 Technologie/Matériels
Technologie/Matériels
 Science
Science
 Evénements et animations
Evénements et animations


