La mesure du lactate sanguin est un marqueur physiologique largement utilisé par les entraîneurs et athlètes comme témoin de l’intensité de l’exercice ou du statut de récupération à l’image de la fréquence cardiaque ou la consommation d’oxygène.
Si traditionnellement la mesure du lactate sanguin était faite en laboratoire avec des dispositifs de tables comme le Biosen, il existe aujourd’hui plusieurs dispositifs portables comme le lactate Scout ou le lactate pro 2 qui ont participé à la démocratisation de la mesure du lactate sur le terrain par les entraîneurs et les athlètes. Outre la facilité d’utilisation sur le terrain ces appareils présentent également l’avantage d’être moins cher à l’achat et nécessitent des échantillons de sang plus faible pour l’analyse. Bien que ces derniers ont fait l’objet de validations scientifiques (Crotty et al., 2021; Tanner et al., 2010) il convient de suivre certaines bonnes pratiques afin de s’assurer de résultats précis et fiables. En effet, la taille réduite de l’échantillon expose la mesure à une importante distorsion si celui-ci est dilué avec de la sueur, par exemple.
Préparation de l’analyseur
Pour les analyseurs portables, les prélèvements sanguins capillaires s’effectuent via des réactifs à usage unique. Ces derniers doivent être conservé à l’abri de la lumière et à température constante en suivant les recommandations des fabricants (-18°C à 8°C pour les réactifs Lactate Scout Sport et 1 à 30 °C pour les réactifs lactate Pro 2. Avant de procéder à la mesure le réactif et l’appareil doivent être ajustés à la température ambiante. Le réactif doit, ensuite, être inséré dans l’appareil sans que la chambre de mesure, partie ou l’échantillon sanguin est absorbé, ne soit touché
Collecte de l’échantillon sanguin
La méthodologie indiquée s’appuie sur les recommandations de l’organisation mondiale de la santé pour la réalisation de prélèvement sanguin (World Health Organization, 2012).
Préparatif
- Rassembler l’ensemble du matériel sur une surface propre, sûre et facile à atteindre.
- Pratiquer les gestes d’hygiène des mains se laver les mains précautionneusement en utilisant un savon et de l’eau ou une solution hydro-alcolique durant 30 secondes. Si de l’eau et du savon ont été utilisés, se sécher les mains avec des serviettes à usage unique.
- S’équiper d’une paire de gants à usage unique.
Procédure de prélèvement
- Désinfecter la peau au niveau du site de ponction à l’aide d‘un tampon imprégné d’alcool isopropylique à 70% et laisser sécher complètement la zone (De Vries et al., 1997).
- Perforer la peau en utilisant une lancette à usage unique selon un mouvement rapide, continu et mesuré afin d’avoir un bon écoulement du sang et ne pas avoir à répéter la piqûre.
- Jeter les dispositifs dans un collecteur à déchets piquants/tranchants solide.
- Essuyer la première goutte de sang car elle peut être contaminée par les fluides ou des débris tissulaires, à l’aide d’une compresse de gaze ou un morceau de coton. - Appuyer légèrement autour de la zone de prélèvement pour obtenir une goutte de sang. Eviter d’exercer une pression trop forte car cela peut entraîner une dilution de l’échantillon avec des fluides tissulaires (plasma) et augmente le risque d’hémolyse (Meites, 1988).
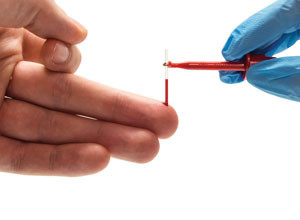
- Prélever la goutte de sang avec l’appareil doté du réactif. La goutte ne doit pas couler, le réactif doit être placé à proximité de la goutte de sang de façon perpendiculaire à la goutte afin que le réactif absorbe par capillarité le sang dans la chambre de mesure. La goutte doit être suffisamment grande pour remplir la chambre de mesure en seule fois. Le Lactate Pro 2, nécessite un volume de 0,3 μL de sang pour effectuer la mesure contre 0,2 μL pour le Lactate Scout Sport.
- Une fois la chambre de mesure remplie, un signal sonore indique le début de l’analyse par l’appareil. Après quelques secondes (10 sec pour le Lactate Scout Sport et 15 sec pour le Lactate Pro 2) le résultat du test apparait sur l’écran de l’appareil dans l’unité de mesure « mmol/L ».

Site de prélèvement
Le doigt est généralement le site favorisé pour un prélèvement sanguin capillaire chez l’adulte. Privilégier le prélèvement sur le majeur et l’annulaire, éviter le pouce et l’index en raison des callosités mais également le petit doigt car les tissus sont très fins. Dans certains cas, le lobe de l’oreille peut être préféré en se révélant plus pratique dans certaines situations, à l’exercice par exemple. Celui-ci peut également être privilégié lorsque le sujet est dans une position pouvant entraîner une réduction du flux sanguin au niveau des doigts, notamment chez le cycliste par la tenue du cintre du vélo. Si le site de prélèvement semble avoir un impact minime sur les résultats de lactatémie, il convient néanmoins de conserver le même site d’analyse pour une série de mesures sur le sujet (Moran et al., 2012).
Il n’est pas rare d’obtenir des résultats inattendus par un mauvais processus de prélèvement. De nombreuses erreurs peuvent subvenir durant ce processus : réactif périmé, pollution de l’échantillon, volume de sang insuffisant, etc. Le suivi des recommandations pour la collecte de l’échantillon, accompagné d’une pratique régulière et d’un peu d’expérience entraine une grande fiabilité dans les résultats des prélèvements.
|
Lucas Garbellotto. Phd Avide de découvertes, technophile en herbe ! |
Bibliographie
- Crotty, N. M., Boland, M., Mahony, N., Donne, B., & Fleming, N. (2021). Reliability and Validity of the Lactate Pro 2 Analyzer. Measurement in Physical Education and Exercise Science, 25(3), 202‑211. https://doi.org/10.1080/1091367X.2020.1865966
- De Vries, J., Van Dorp, W., & Van Barneveld, P. (1997). A randomized trial of alcohol 70% versus alcoholic iodine 2% in skin disinfection before insertion of peripheral infusion catheters. Journal of Hospital infection, 36(4), 317‑320.
- Meites, S. (1988). Skin-puncture and blood-collecting technique for infants : Update and problems. Clinical chemistry, 34(9), 1890‑1894.
- Moran, P., Prichard, J. G., Ansley, L., & Howatson, G. (2012). The Influence of Blood Lactate Sample Site on Exercise Prescription. Journal of Strength and Conditioning Research, 26(2), 563‑567. https://doi.org/10.1519/JSC.0b013e318225f395
- Tanner, R. K., Fuller, K. L., & Ross, M. L. R. (2010). Evaluation of three portable blood lactate analysers : Lactate Pro, Lactate Scout and Lactate Plus. European Journal of Applied Physiology, 109(3), 551‑559. https://doi.org/10.1007/s00421-010-1379-9
- World Health Organization. (2012). Lignes directrices de l’OMS applicables aux prélèvements sanguins : Les meilleures pratiques en phlébotomie. https://www.ncbi.nlm.nih.gov/books/NBK138651/bin/french-m1.pdf






















































 Tapis Anti Gravité : quand la réduction de la gravité transforme la rééducation
Tapis Anti Gravité : quand la réduction de la gravité transforme la rééducation
 Différences de raideur au sein du tendon rotulien
Différences de raideur au sein du tendon rotulien
 NIRS et canaux courts : une méthode utile en musculaire et cérébrale
NIRS et canaux courts : une méthode utile en musculaire et cérébrale
 Banc de mesure de force pour les perches. Mais pourquoi?
Banc de mesure de force pour les perches. Mais pourquoi?
 Comment effectuer des prélèvements de lactate sanguin
Comment effectuer des prélèvements de lactate sanguin
 Actualités
Actualités
 Technologie/Matériels
Technologie/Matériels
 Science
Science
 Evénements et animations
Evénements et animations